生物制药设备清洁验证中复杂化合物的回收率
目的
为表明Sievers* 总有机碳(TOC)分析仪,对具有高分子量与复杂化学结构的化合物的回收能力,本研究中的这些化合物,通常被认为难于被非燃烧/红外检测的TOC仪器氧化并准确检测。

结论
Sievers TOC分析仪回收标准溶液中这些化合物的能力非常好。牛血清白蛋白(BSA)、头孢他啶(CP) 、葡聚糖硫酸酯(DS ) 、牛血红蛋白(Heme)和人胰岛素(HI),以平均95%被回收。本研究为清洁验证的非专属但高度灵敏的TOC分析方法提供支持,特别是本案例中的UV/过硫酸盐方法。此应用具有巨大的价值,因为与其他方法相比,该技术具有低水平的检测限(ppb)、分析时间快并且操作成本低。
讨论
国际医药科技协会(PDA)列出了用于验证和监控清洁的许多合适的物理、化学和生物技术,其中包括针对特殊分子的试验以及许多非特定试验。在查看性能比较和参考之后,PDA特别提到,“典型的清洁验证研究可使用pH、电导率、总有机碳、洗涤剂试验,若有多产品设备,则使用产品专用的试验。”应比较分析的精度、准确度、检测限、定量限、选择性、线性、范围和灵敏度。进行了许多科学研究以评测性能,比如符合的通用方法:高性能液相色谱(HPLC)、薄层色谱(TLC)、UV光谱、总有机碳( TOC ) 、酶联免疫吸附剂测定(ELISA)、胶体电泳和电导率等常用方法。药物残留、赋形剂、清洗剂残留和反应副产物都显示了该方法的优点和缺点。
仔细选择清洁验证(CV)分析的仪器应是任何清洁验证主计划实施的一部分。TOC的使用,应该是仅有的几种类型 之一,以其氧化方式不同为特点。可使用燃烧炉、加热的过硫酸盐溶液或者紫外灯存在下的过硫酸盐溶液进行氧化。Sievers Model 使用UV/过硫酸盐氧化方法,并使用其专利膜电导测量技术测定清洁验证样品的TOC浓度。
本研究检验牛血清白蛋白(BSA)、头孢他啶(CP) 、葡聚糖硫酸酯(DS ) 、牛血红蛋白(Heme)和人胰岛素(HI)在多种浓度下的回收率。表1所示为回收数据一览表。
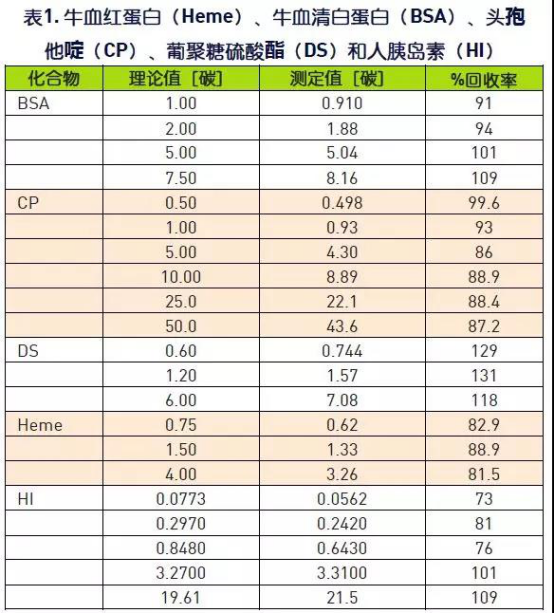
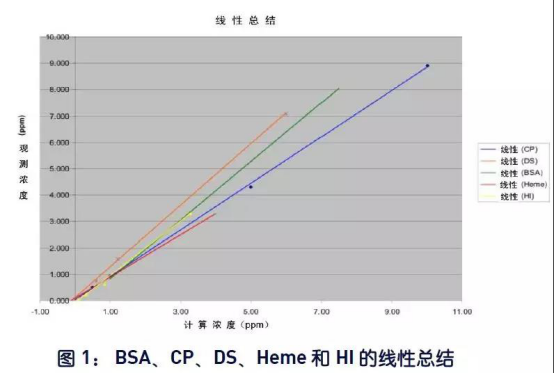
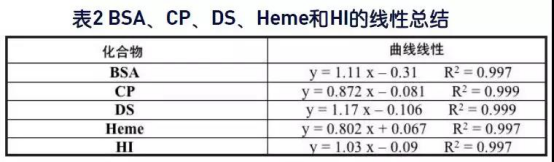
所研究化合物的平均回收率为95.9%,范围在73%至129%之间。化合物回收率很好且在预料之中,然而葡聚糖硫酸酯的回收率范围在118%至131%之间。 在此研究时,还不清楚这么高回收率的引起原因,但对化合物进行进一步查看,以便找到可能的解释。值得注意的是,葡聚糖硫酸酯以及其他的所有化合物的回收率线性在浓度范围内非常好。这使得可通过应用相关的曲线方程方便地预测未知浓度的样品。图1是包含各化合物线性的图,而各公式在表2中。所研究各化合物的线性非常好。
小结
当进行回收这组生物医药行业常用的大分子时,Sievers TOC分析仪进行得很好。表明UV/过硫酸盐法可用于将化合物中所含的碳氧化为CO2,进行量化。 许多医药相关的设备已经成为非特定但高灵敏度TOC分析仪用于清洁验证的很好案例,请注意与其他方法相比,该技术检测含量低(ppb)、分析时间快并且成本低,而且可检测众多碳基残留。
材料和技术
试剂
1. 6M的磷酸溶液
在含有1L低TOC水的5L容量瓶中加入2 L 85%的磷酸,并用低TOC水稀释到体积刻度。
2. 15%过硫酸铵溶液
在5L低TOC水中溶解750 g过硫酸铵。
3. 低TOC水。
材料
1. 牛血清白蛋白(BSA):Fluka已测定@54.45%碳。
2. 人胰岛素(HI):Fluka已测定@44.1%碳。
3. 头孢他啶(CP):SmithKline Beecham已测定@41.5%碳。
4. 葡聚糖硫酸酯(DS):Aldrich已测定@18.56 %碳。
5. 牛血红蛋白(Heme):Aldrich已测定@49.87 %碳。
6. 容量瓶和移液管(使用稀释的Steris CIP 100™溶液清洗并使用20 次低TOC 水漂洗)。
仪器
1.Sievers 总有机碳分析仪
2.Sievers TOC 自动进样器
参考资料
✦1. Agalloco J. “Points to consider in the Validation of Equipment Cleaning Procedures,”(设备清洁步骤验证中的注意点),J. Parenteral Sci. Tech., 46 (5): 163-168, (1992) Cooper D. W., Cleaning Aseptic Fill Areas,. Pharm. Technol. 20(2): 52-60 (1996)
✦2. Dolch G., Baffi R., Garnick R., Huang Y. F., Mar B., Matsuhiro D., Niepelt B., Parra C., Stephan M., “A Total Organic Carbon Analysis Method for Validating Cleaning Between Products in Biopharmaceutical Manufacturing,”(用于生物医药生产中清洁验证的总有机分析方法),J. Parenteral Sci. Tech.,45 (1): 13-19, (1991)
✦3. FDA Guide to Inspections of Validation of Cleaning Processes(清洁验证步骤检查的FDA指南),July 1993, p. 8.
✦4. Godec R., Kosenka P., Hutte R., “Method and Apparatus for the Determination of Dissolved Carbon in Water,”(水中溶解碳测定的方法和器械),U.S. Patent No. 5,132,094 (July 21, 1992)
✦5. Harder S. W., “The Validation of Cleaning Procedures,”(清洁步骤的验证),Pharm. Technol., 8 (5), 29-34 (1984)
✦6. Jenkins K. M., and Vanderweilen A. J., “Cleaning Validation: An Overall Perspective,”(清洁验证:全面观察),Pharm. Technol., 18 (4), 60-74, (1994).
✦7. Parenteral Drug Association, Cleaning and Cleaning Validation: A Biotechnology Perspective(非肠道药物协会,清洁和清洁验证:生物技术展望),PDA, Bethesda, MD, 1996
✦8. Smith J. M., “Selecting Analytical Methods to Detect Residue from Cleaning Compounds in Validated Process Systems,”(选择分析方法以检测来自验证的工艺系统中清洗化合物的残留),Pharm. Technol., 17 (6), 88-98 (1993)
